Zat dapat dikategorikan sebagai elektrolit kuat apa itu elektrolit kuat dan elektrolit lemah. Larutan elektrolit lemah.
2 Uraian Materi
Contoh larutan elektrolit kuat dan lemah. Contoh elektrolit lemah yaitu ch3cooh hf h2co3 nh4oh aloh3 dan h3po4. Contohnya pada larutan elektrolit lemah yaitu. Contoh reaksi elektrolit kuat. Selain melakukan percobaan larutan elektrolit dapat ditentukan kuat atau lemahnya dengan derajat ionisasi. Salah satu contoh dari asam lemah yang juga merupakan elektrolit lemah ialah asam asetat hc2h3o2. Elektrolit lemah biasanya berasal dari dua jenis larutan yakni asam lemah dan basa lemah.
Asam asetat memiliki karakter yang berbeda dari asam kuat karena jika dilarutkan dalam air asam asetat tidak akan terionisasi sempurna hanya sekitar 1 dari molekulnya yang akan terdisosiasi menjadi ion. Hello sobat dan adik adik. Pengertian contoh perbedaan adalah materi yang akan dijelaskan. Pada kesempatan yang luar biasa ini mas dennis akan membahas mengenai suatu materi yang sangat menarik yaitu ciri ciri dan contoh dari senyawa elektrolit kuat elektrolit lemah dan senyawa non elektrolit. Derajat ionisasi adalah perbandingan jumlah mol zat yang terionisasi dengan mol zat mula mula. Contoh larutan elektrolit lemah yaitu senyawa senyawa asam lemah dan basa lemah seperti h 2 c 2 o 4 ch 3 cooh n 2 h 4 dan nh 3.
Pada pembahasan sebelumnya mas dennis telah mengupas tuntas mengenai pengertian dari senyawa elektrolit dan senyawa non elektrolit jadi. Dalam pembahasan terdahulu telah dikupas secara lengkap mengenai pengertian dari larutan elektrolit dan larutan non elektrolit. Secara kuantitatif kuat lemahnya elektrolit dapat dinyatakan sebagai derajat ionisasi derajat disosiasi α. Larutan elektrolit kuat yaitu larutan elektrolit yang mengalami ionisasi sempurna. Asam lemah hcn h3po4 ch3cooh dan c2o3. Tutorial materi pembelajaran kimia kita kali ini adalah berkenaan dengan contoh contoh dari larutan elektrolit kuat larutan elektrolit lemah dan larutan non elektrolit.
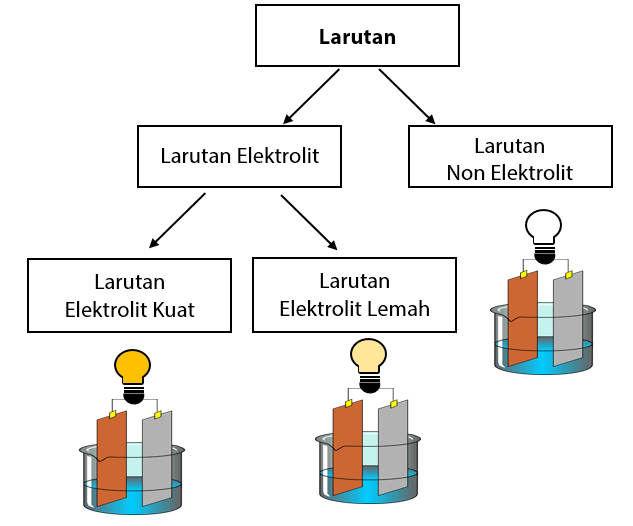
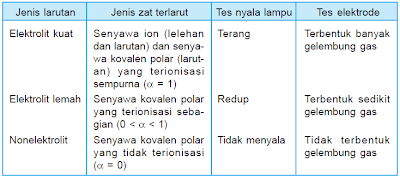
Larutan elektrolit lemah merupakan larutan yang molekulnya tidak semuanya sempurna terionisasi. Berdasarkan kuat lemahnya daya hantar listrik larutan elektrolit dapat dikelompokkan menjadi dua yaitu. Larutan elektrolit lemah yakni larutan yang tidak semua molekulnya terionisasi ionisasi tidak sempurna sehingga hanya sedikit ion ion yang dapat menghantarkan listrik. Daya hantar listrik larutan elektrolit bergantung pada jenis dan konsentrasinya. Beberapa larutan elektrolit dapat menghantarkan arus listrik dengan baik meskipun konsentrasinya kecil larutan ini dinamakan elektrolit kuat. Larutan elektrolit kuat dan larutan elektrolit lemah.
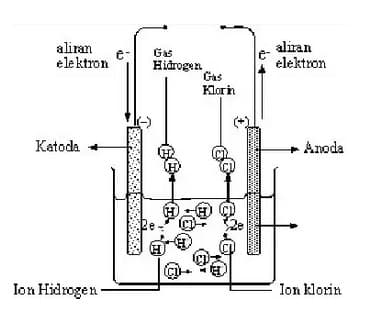
Elektrolit kuat dan elektrolit lemah. Elektrolit adalah bahan kimia yang memecah menjadi ion terionisasi ketika mereka dilarutkan dalam air. Nacl aq na aq cl aq h2so4 aq 2 h aq so4 2 aq naoh aq na aq oh aq 2. Lampu menyala terang dan timbul gel. Sedangkan larutan elektrolit yang mempunyai daya hantar lemah meskipun konsentrasinya tinggi dinamakan elektrolit lemah. Pengertian contoh perbedaan dibahas lengkap dan gambar untuk pembaca semua simak disini.
Karena itu molekul yang terurai menjadi ion ion hanya sedikit yang bisa menghantarkan listrik.